血管钙化是心血管死亡的独立危险因素,是心血管疾病发病率与死亡率的重要预测因子,是糖尿病、慢性肾脏疾病(CKD)和动脉粥样硬化常见的病理改变和并发症之一。在血管钙化发生的早期,临床上尚无有效逆转钙化发生的干预措施。随着血管钙化的加剧,患者往往需要进行血管置换。组织工程血管(TEBVs)是一种很有前景的生物血管替代品。然而,当TEBVs植入患有糖尿病等基础疾病的患者时,移植物同样容易发生钙化,并导致植入失败。对于TEBVs,一方面需要促进平滑肌细胞快速正常的重建以抵抗动脉瘤的发生,另一方面需要抑制钙化以维持长期稳态和血管通畅。目前,这两个方面都尚无有效的解决办法。
内源性血管祖细胞在病理条件下血管重塑的发生和发展中发挥作用,Gli1+细胞具有间充质干细胞形态和典型的表面标记物,在组织中形成广泛的血管周围网络,并存在于血管外膜。Gli1+细胞能促进再生型H血管的形成,用于组织再生和修复。最近的研究表明,Gli1+细胞是血管平滑肌细胞的祖细胞,在急性血管损伤中可分化为高度分化的平滑肌细胞,而在慢性血管损伤疾病中,Gli1+细胞可分化为成骨细胞样细胞并导致血管钙化。因此,在体靶向Gli1+细胞进行重编程可能是治疗血管钙化的新方法。 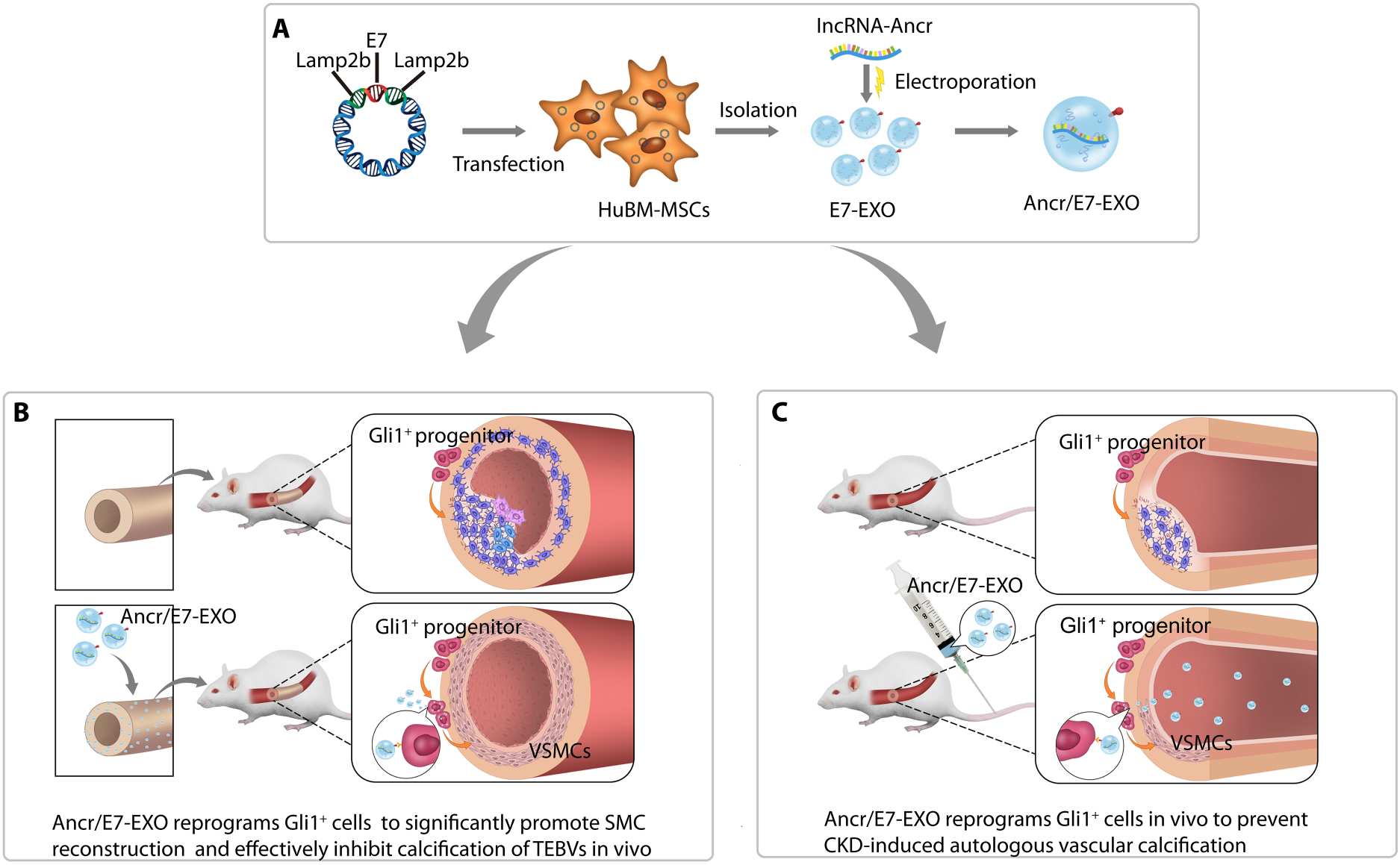
2023年7月21日,陆军军医大学曾文教授课题组在Science Advances在线发表题为Engineered exosomes reprogram Gli1+ cells in vivo to prevent calcification of vascular grafts and autologous pathological vessels的研究论文。该研究设计了一种工程化外泌体,通过基因工程对间充干细胞分泌的外泌体表面进行修饰以实现靶向,并向外泌体中引入lncRNA-ANCR,用于Gli1+细胞的在体靶向重编程,从而促进TEBVs平滑肌层重建与抑制TEBVs和自体血管钙化。研究团队首次解析了Gli1+细胞在TEBVs的时空分布规律,发现Gli1+细胞在正常生理和病理状态下均与TEBVs钙化程度呈正相关,首次证实Gli1+细胞是TEBVs钙化的主要细胞来源,也验证了Gli1+细胞是自体血管钙化的关键贡献者。
研究者希望通过工程化方法将外泌体治疗与长链非编码RNA(lncRNA)治疗相结合,并通过负载lncRNA ANCR和靶向Gli1+细胞来调节Gli1+细胞的分化趋势。在本研究中,研究者设计并构建了Lamp2b-E7质粒,将其转染到人骨髓间充质干细胞(HuBM-MSCs)中,并通过电穿孔将lncRNA-ANCR引入HuBM-MSC衍生的E7-EXO中,构建了工程外泌体Ancr/E7-EXO。通过尾静脉注射,Ancr/E7-EXO可以募集到CKD大鼠主动脉弓血管钙化部位,高效在体亲和Gli1+细胞,进而抑制Gli1+细胞的成骨分化。利用EDC/NHS共价交联将Ancr/E7-EXO修饰到TEBVs,移植后可观察到Gli1+细胞能吞噬工程化外泌体,在高糖环境中调节Gli1+细胞分化为收缩型平滑肌细胞(SMC),促进TEBVs中SMCs重建,有效抑制移植物钙化。
经Ancr/E7-EXO修饰的TEBVs在植入8周后,内膜增生得到了抑制,TEBVs的通畅性和血管形态也显著改善。通过原子力显微镜,经Ancr/E7-EXO修饰的TEBVs移植到糖尿病个体中仍然能保持正常硬度。免疫荧光分析显示,经Ancr/E7-EXO修饰的TEBVs和治疗的自体血管具有更多的平滑肌细胞标志物和Gli1+细胞共定位,表明Ancr/E7-EXO促进Gli1+细胞向平滑肌分化。而对照组拥有更多的成骨样标志物与Gli1+细胞共定位,表明Ancr/E7-EXO可显著抑制Gli1+细胞向成骨表型分化。
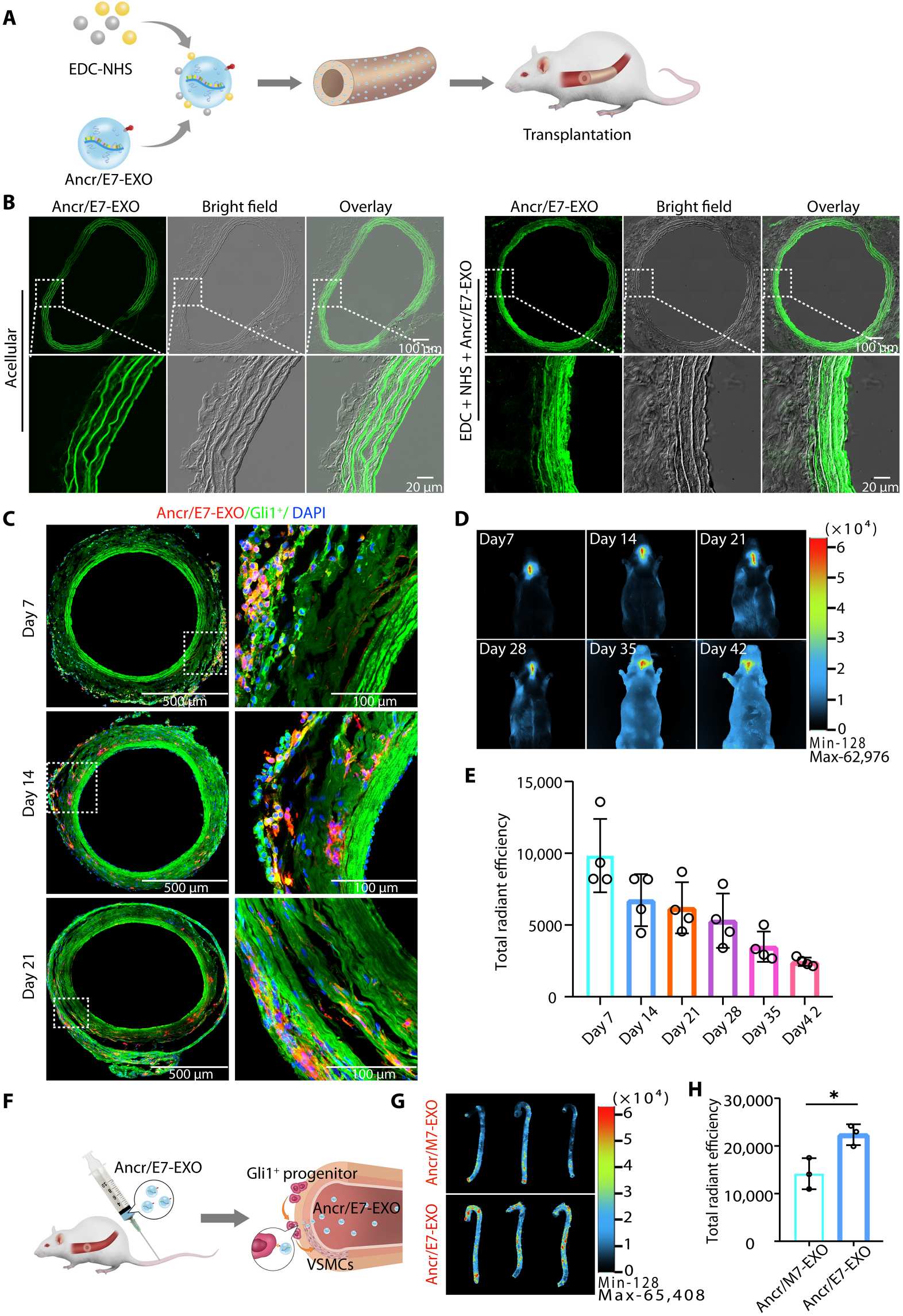
综上所述,该研究设计的工程化外泌体Ancr/E7-EXO在体重编程Gli1+细胞,一石二鸟,一方面促进血管平滑肌细胞的重建,另一方面抑制血管钙化,为自体血管和移植物抗钙化提供了一种新的理论和策略。其中,Ancr/E7-EXO标记DiR后,在大鼠活体内的稳定性成测试,均由Vilber最新一代NEWTON系列小动物活体成像系统来完成。