7月20日,厦门大学夏宁邵教授团队在国际著名学术期刊《Science》子刊《科学·转化医学》上发表了题为“A recombinant spike protein subunit vaccine confers protective immunity against SARS-CoV-2 infection and transmission inhamsters”的研究论文。该研究开发了一种基于重组刺突蛋白和创新佐剂的新型冠状病毒重组蛋白疫苗,在多种动物模型中验证了该疫苗的免疫原性和有效性,为新冠肺炎疫情的防控提供了一种新的候选疫苗。

由严重急性呼吸系统综合症冠状病毒2(SARS-CoV-2)引起的冠状病毒大流行正在改变全球公共卫生的格局。迄今为止,全球已有218个国家和地区确认了SARS-CoV-2感染,确诊的COVID-19病例超过1.88亿,死亡人数超过400万。安全有效的新冠疫苗是控制新冠病毒流行的重要手段。目前全球范围内已有多种疫苗上市或被应急使用,临床试验和真实世界的研究数据已证明接种新冠疫苗能有效降低病毒感染风险并减轻疾病严重程度。然而,能否通过强效疫苗免疫使个体获得针对新冠病毒的消除性免疫(sterilizing immunity)从而有效抑制病毒传播风险,尚待进一步研究阐明。
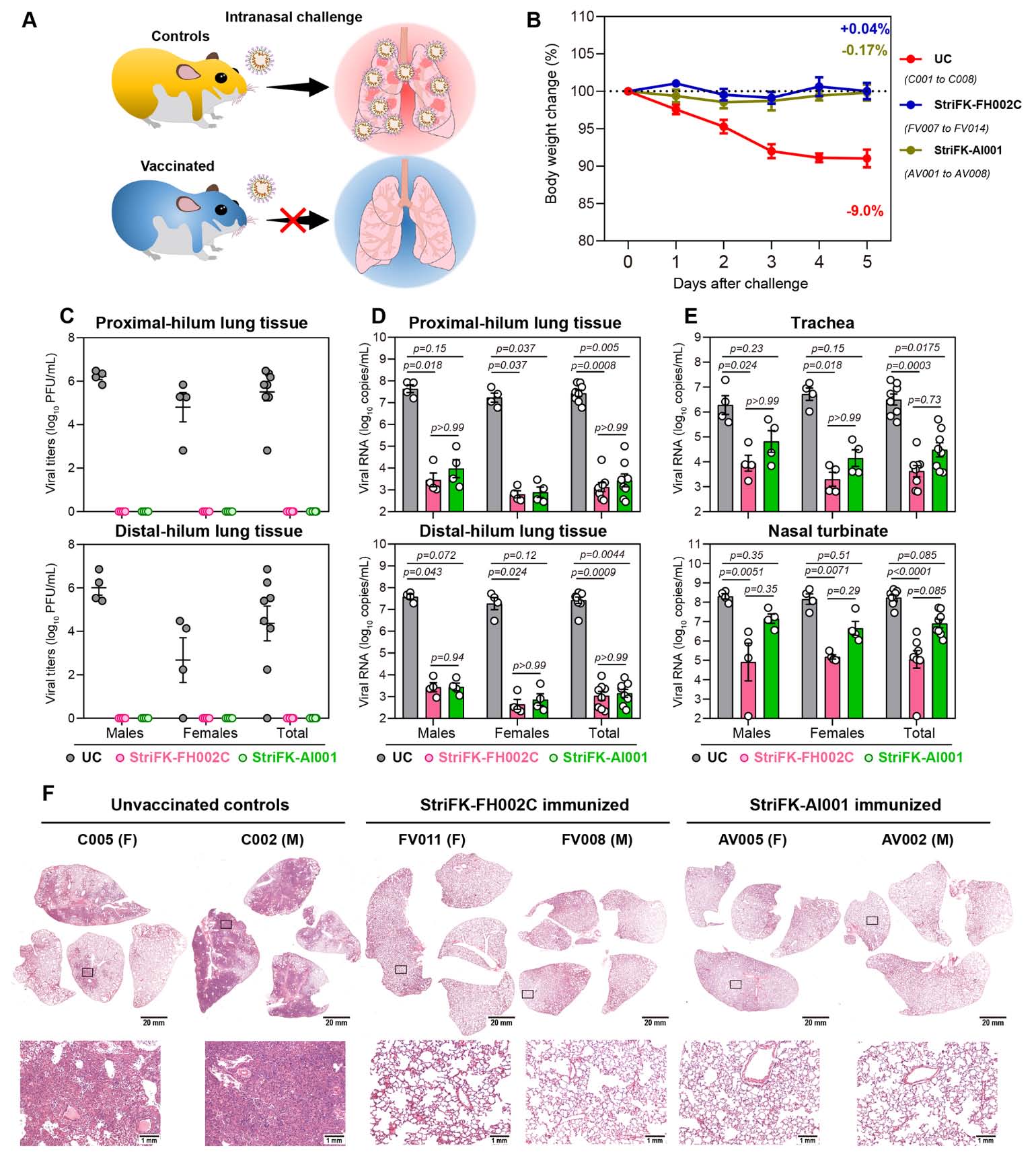
在该项研究中,研究人员设计了基于CHO细胞表达的SARS-CoV-2重组刺突蛋白的免疫原StriFK和创新佐剂FH002C的新型冠状病毒重组蛋白疫苗StriFK-FH002C。该疫苗在小鼠、仓鼠和食蟹猴中均诱导产生了高滴度的中和抗体,比人COVID-19恢复期血浆的中和抗体高30至250倍,在中和抗体产生速度和强度方面均比传统铝佐剂疫苗具有显著优势。同时,StriFK-FH002C疫苗在小鼠体内能够诱导强烈的细胞免疫反应,克服了传统铝佐剂诱导细胞免疫应答能力不足的弱点。在保护性试验中,研究人员在使用模拟人类中重症新冠肺炎的仓鼠动物模型中,采用直接攻毒和密接传播两种攻毒模式证明了StriFK-FH002C免疫能赋予仓鼠良好的抵御新冠病毒的保护效果:显著降低鼻甲、气管和肺等呼吸道组织的病毒载量,使受试动物免于新冠感染所致肺组织病变。更为重要的是,该研究采用空气传播试验表明StriFK-FH002C疫苗接种不仅能保护接种疫苗的动物,也能有效降低病毒从疫苗接种后个体传播至未接种疫苗个体并导致疾病的风险。通过对比分析攻毒前后的抗体应答变化,研究证实至少在部分动物中,StriFK-FH002C疫苗免疫能够赋予动物针对新冠病毒的消除性免疫(sterilizing immunity)。
其中,CHO细胞纯化蛋白的SDS-PAGE及Western blot分析,均由Vilber Fusion FX多功能成像系统来完成。这是FUSION FX成像系统助力新冠研究的又一重要成果......